برقی رو کے ذرائع
الیکٹرک کرنٹ — اسے کیسے بنایا جائے اور اسے برقرار رکھا جائے۔
 چارج شدہ ذرات کی منظم حرکت کو برقی کرنٹ کہتے ہیں۔ کسی تار میں برقی رو حاصل کرنے کے لیے، آپ کو اس میں برقی میدان بنانا ہوگا۔ اگر چارج شدہ جسم کو تار کے ذریعے زمین سے جوڑا جاتا ہے، تو تار میں ایک مختصر مدت کے لیے برقی رو پیدا ہوتا ہے۔ ایک تار میں برقی فیلڈ حاصل کرنے اور اسے برقرار رکھنے کے لیے، برقی رو کے ذرائع استعمال کریں۔
چارج شدہ ذرات کی منظم حرکت کو برقی کرنٹ کہتے ہیں۔ کسی تار میں برقی رو حاصل کرنے کے لیے، آپ کو اس میں برقی میدان بنانا ہوگا۔ اگر چارج شدہ جسم کو تار کے ذریعے زمین سے جوڑا جاتا ہے، تو تار میں ایک مختصر مدت کے لیے برقی رو پیدا ہوتا ہے۔ ایک تار میں برقی فیلڈ حاصل کرنے اور اسے برقرار رکھنے کے لیے، برقی رو کے ذرائع استعمال کریں۔
کسی بھی موجودہ ذریعہ میں، مثبت اور منفی چارج شدہ ذرات کو الگ کرنے کے لیے کام کیا جاتا ہے۔ الگ الگ ذرات ماخذ کے کھمبوں پر جمع ہوتے ہیں۔ کھمبوں کے درمیان ایک برقی میدان پیدا ہوتا ہے۔ اگر آپ انہیں تار سے جوڑتے ہیں، تو کھیت تار میں پیدا ہوتی ہے۔
الیکٹرک مشین میں چارجز کی علیحدگی مکینیکل انرجی کی مدد سے کی جاتی ہے۔ ایک ہی وقت میں، یہ برقی بن جاتا ہے. تھرموکوپل میں اندرونی توانائی برقی توانائی میں بدل جاتی ہے۔ نیوکلیئر بیٹریاں جوہری توانائی کو بجلی میں تبدیل کرتی ہیں۔
فوٹو سیل روشنی کی توانائی کو برقی توانائی میں تبدیل کرتا ہے۔ شمسی خلیات فوٹو سیلز سے بنتے ہیں۔انہیں استعمال کیا جاتا ہے جہاں ہلکی توانائی سب سے زیادہ آسانی سے دستیاب ہوتی ہے۔
دریاؤں، کوئلے، تیل اور ایٹموں کی توانائی کو پاور پلانٹس میں برقی توانائی میں تبدیل کیا جاتا ہے۔ برقی رو کے سب سے عام ذرائع جستی خلیات اور بیٹریاں ہیں۔
گالوانی خلیات
ایک galvanic سیل ایک موجودہ ذریعہ ہے جس میں کیمیائی توانائی کو برقی توانائی میں تبدیل کیا جاتا ہے.
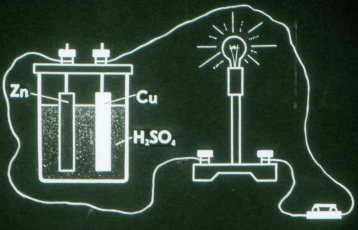
اس طرح سب سے آسان گالوانک سیل کام کرتا ہے۔
پہلا الیکٹرو کیمیکل سیل 1799 میں وولٹ نے ایجاد کیا تھا۔ انفرادی عناصر سے اس نے ایک بیٹری بنائی جسے اس نے "وولٹ پول" کہا۔ ایک گالوانک سیل میں، الیکٹروڈز کو لازمی طور پر حل کے ساتھ مختلف طریقوں سے تعامل کرنا چاہیے، یہی وجہ ہے کہ الیکٹروڈ مختلف مواد سے بنے ہیں۔

وولٹا سیل میں زنک پلیٹ منفی چارج ہوتی ہے اور تانبے کی پلیٹ مثبت چارج ہوتی ہے۔
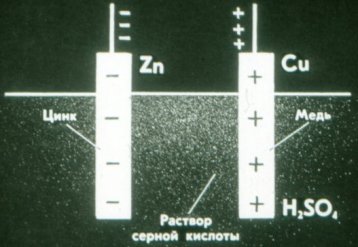
اور اس طرح ایک خشک گالوانی سیل کام کرتا ہے۔ مائع کی بجائے، یہ ایک موٹا پیسٹ استعمال کرتا ہے:
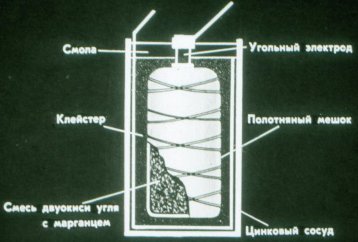
ایک بیٹری کئی عناصر پر مشتمل ہو سکتی ہے:

الیکٹرک لیمپوں میں روشنی کے بلب کے ساتھ ساتھ مختلف دیگر پورٹیبل برقی آلات اور بچوں کے کھلونے، galvanic خلیات سے چلتے ہیں۔ جب گالوانک سیل میں الیکٹروڈ استعمال ہو جاتے ہیں، تو سیل کو ایک نئے سے تبدیل کر دیا جاتا ہے۔
بیٹریاں
بیٹریاں برقی رو کے کیمیائی ذرائع ہیں جن میں الیکٹروڈ استعمال نہیں ہوتے ہیں۔ سب سے آسان بیٹری سلفیورک ایسڈ کے محلول میں ڈوبی ہوئی دو لیڈ پلیٹوں پر مشتمل ہوتی ہے۔
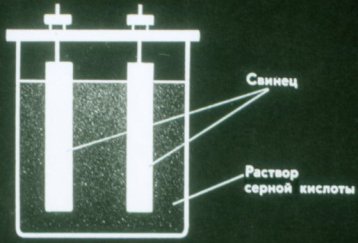
ایسی بیٹری اب بھی کرنٹ فراہم نہیں کرتی۔ اسے استعمال کرنے سے پہلے چارج کیا جانا چاہیے۔ ایسا کرنے کے لیے، بیٹری کے کھمبوں کو ہر موجودہ ذریعہ کے ایک ہی کھمبے سے جوڑیں۔
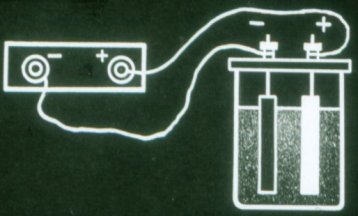
چارجنگ کے دوران بیٹری سے گزرنے والا کرنٹ اس کی پلیٹوں کی کیمیائی ساخت کو تبدیل کرتا ہے۔ بیٹری کی کیمیائی توانائی بڑھ جاتی ہے۔
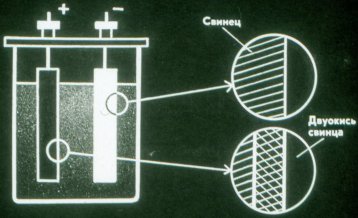
جب بیٹری خارج ہوتی ہے، تو یہ کیمیائی توانائی کو برقی توانائی میں بدل دیتی ہے۔ خارج ہونے والی بیٹری کو دوبارہ چارج کیا جا سکتا ہے۔
بیٹریاں الگ بیٹریوں سے جمع کی جاتی ہیں۔
تیزاب (لیڈ) بیٹریوں کے علاوہ، الکلائن (آئرن نکل) بیٹریاں استعمال کی جاتی ہیں۔
نکل آئرن بیٹری:
نکل کیڈیمیم اور نکل میٹل ہائیڈرائڈ بیٹریاں بھی آج کل بڑے پیمانے پر استعمال ہوتی ہیں۔ سلور زنک بیٹریاں ہوا بازی اور خلا میں استعمال ہوتی ہیں۔ نئی قسم کی بیٹریاں: لیتھیم آئن، لیتھیم پولیمر موبائل فون، ٹیبلٹ اور دیگر جدید پورٹیبل آلات میں استعمال ہوتی ہیں۔
بیٹریاں ایسے معاملات میں استعمال ہوتی ہیں جہاں برقی رو کا منبع نئی سے بدلنے کے بجائے ری چارج کرنا زیادہ منافع بخش ہوتا ہے۔ ایک کار میں، بیٹری کا استعمال انجن کو شروع کرنے اور مختلف آلات کو چلانے کے لیے کیا جاتا ہے۔ خلا میں بیٹری سولر پینلز سے چارج ہوتی ہے۔ خارج ہونے پر، یہ ریڈیو ٹرانسمیٹر اور آلات کو طاقت دیتا ہے۔
بھی دیکھو: بیٹریاں۔ حساب کتاب کی مثالیں۔

